Procura-se novos materiais para criar baterias mais duráveis e eficientes. Várias empresas e laboratórios estão desenvolvendo baterias de flúor. Hoje é mostrado estas baterias e suas promessas.
Por quê flúor?
Atualmente, as melhores baterias comerciais disponíveis contêm lítio. Porém, as baterias de íon-lítio podem pegar fogo difícil de extinguir. Já existem casos de carros elétricos com baterias de lítio pegando fogo em estacionamento, clique aqui para ver. Além disso, existe a demanda por baterias mais duradouras.
O flúor é o elemento com maior eletronegatividade, cujo valor é 4,0 e tem baixa massa atômica, cujo valor é 18,998 u. É um elemento muito reativo e perigoso, mas o íon de flúor é estável, pois sua camada de valência é completa com oito elétrons.
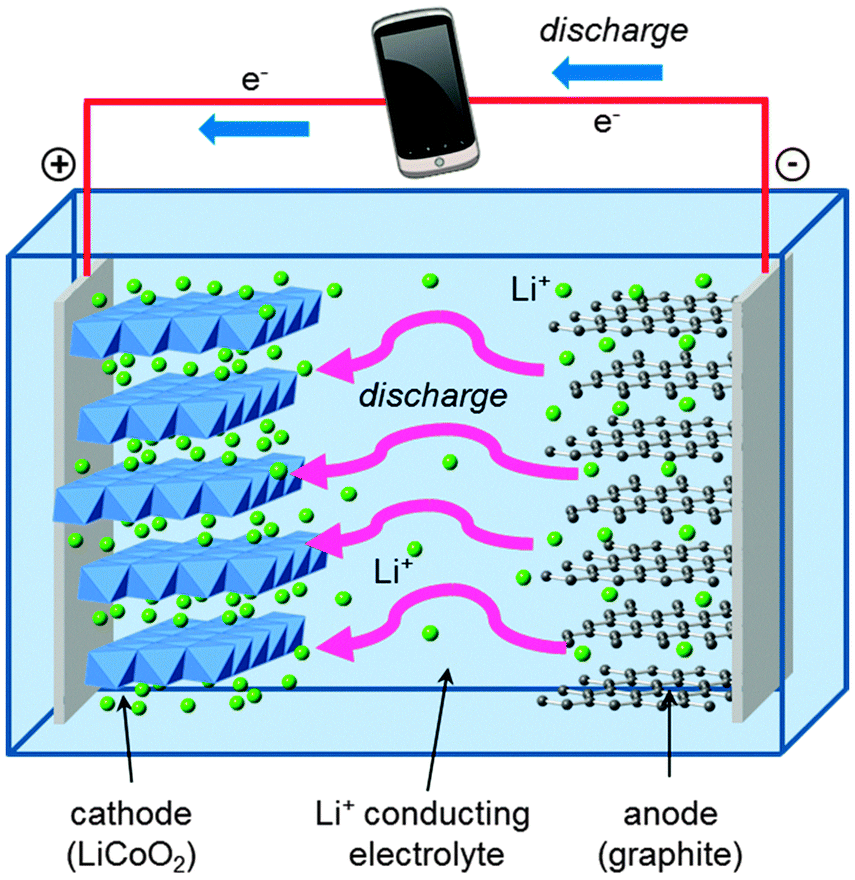
Baterias de flúor podem ter densidade de energia de 8 a 10 vezes maior que as baterias de lítio. Porque o fluoreto metálico pode transferir mais elétrons que o óxido de lítio metálico. Estas são as equações das reações químicas da célula de lítio-íon e o esquemático desta célula respectivamente.
CoO_{2}+Li^{+}+e^{-}\rightleftharpoons LiCoO_{2}
Li^{+}+C_{6}+e^{-}\rightleftharpoons LiC_{6}
Funcionamento da bateria
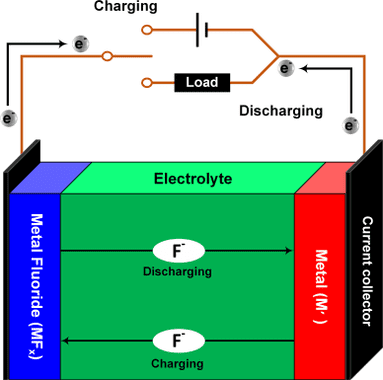
A bateria de flúor é negativa, porque os íons de flúor são negativos. Ao contrário dos íons positivos de lítio. A célula tem um eletrólito onde íons de flúor se movem no sentido de carga (Charging) ou descarga (Discharging). O metal (M') é o anodo e o fluoreto de metal (MF_{x}) é o catodo. Estas equações são as reações químicas de descarga nos eletrodos de catodo e anodo respectivamente, na reação de carga, basta mudar o sentido da seta. Geralmente, o metal M é o cobre (Cu), neste caso, x é igual a 2. Comparando com as equações do íon-lítio acima, pode-se observar que a bateria de flúor move mais elétrons. Portanto, tem maior densidade de energia.
xe^{-}+MF_{x}\rightarrow M+xF^{-}
xF^{-}+M'\rightarrow M'F_{x}+xe^{-}
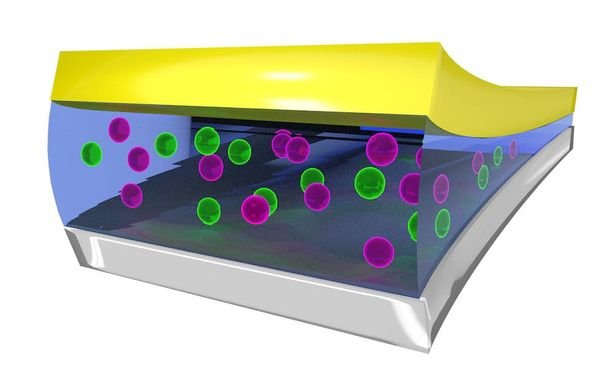
A bateria de flúor não é uma tecnologia nova, foi desenvolvida na década de 1970, mas era impraticável até recentemente. Porque o eletrólito sólido precisa ficar a 150°C para o flúor se dissolver e tornar o eletrólito condutor, esta temperatura é impraticável. Recentemente, por meio de simulações computacionais para testar novos materiais, pesquisadores descobriram um material que pode ser um eletrólito líquido a temperatura ambiente. Se chama bis(2,2,2-trifluoroetil) éter ou BTFE, mantém o íon F^{-} estável para ir de um eletrodo a outro. Nesta imagem, o íon de flúor é a esfera roxa no eletrólito.

Por enquanto, esta célula só está em laboratórios de pesquisa, ainda existem outros obstáculos.
Baterias de flúor para carros elétricos
Como foi explicado no post da comparação entre veículos elétricos e a combustão, a principal vantagem do carro a combustão é a densidade de energia.
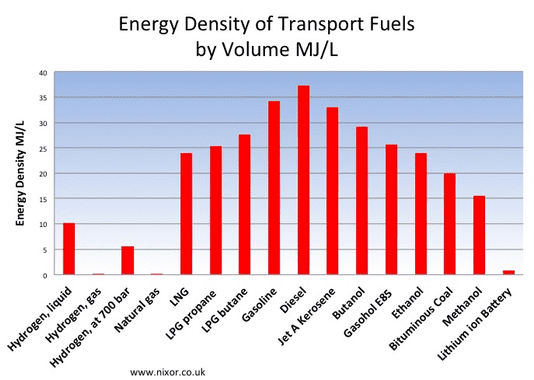
Se uma bateria de flúor tiver 10 vezes mais densidade de energia que a de íon-lítio, pode alcançar o hidrogênio líquido mas ainda será menos denso que a gasolina e o diesel. No entanto, baterias com maior densidade de energia vão aumentar muito a autonomia dos carros elétricos, computadores, drones e smartphones. Por isso, empresas como a Honda investem no desenvolvimento destas novas baterias.