O assunto deste post é o carbono 14. Um isótopo radioativo que permite determinar a idade de um artefato ou ser vivo de milhares de anos atrás.
A formação do carbono 14
O carbono 14 é um isótopo radioativo do carbono com 6 prótons, 6 elétrons e 8 nêutrons.

Os raios cósmicos que chegam na alta atmosfera produzem nêutrons, estes colidem com o nitrogênio 14, produzindo o carbono 14.

O carbono 14 (C14) combina com gás oxigênio para formar o dióxido de carbono (CO_{2}), que é absorvido pelas plantas. Estas são consumidas por animais, que consequentemente absorvem o isótopo quando se alimentam.

Quando uma planta ou animal morre, este não absorve mais o C14. Este isótopo decaí em nitrogênio 14.
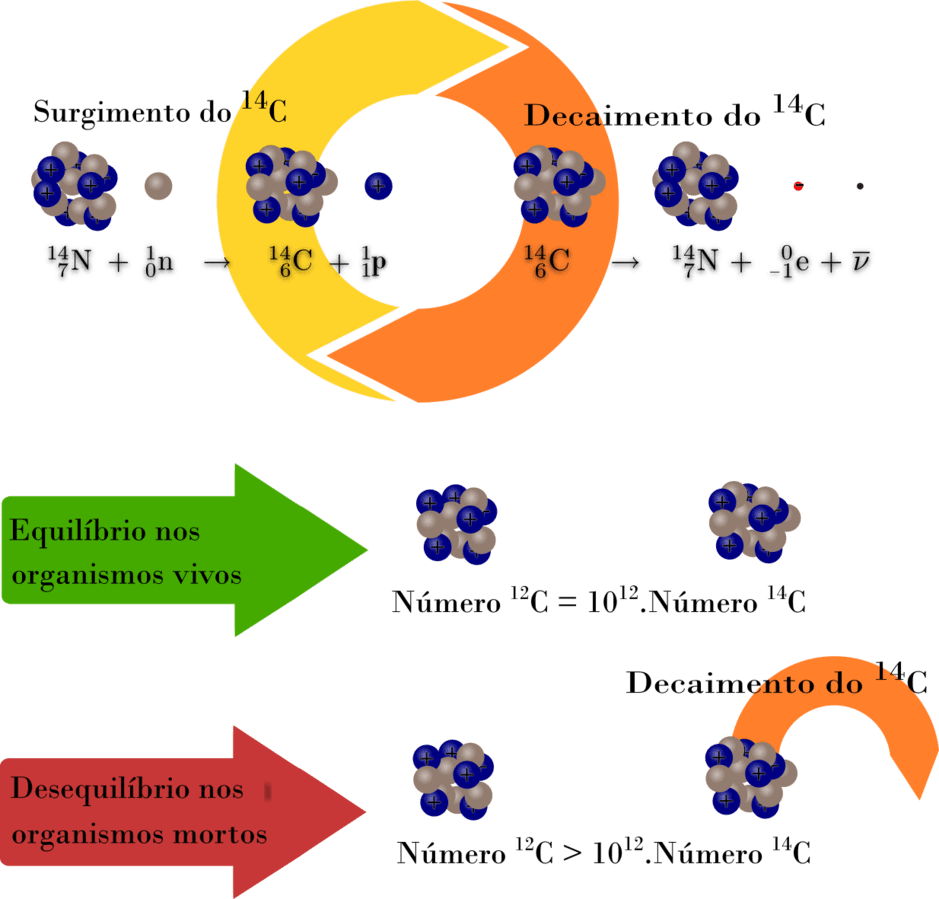
Quanto mais antigo for o material orgânico, menor a quantidade de carbono 14 remanescente e menor a emissão de partículas beta (elétrons).


Cálculo do decaimento radioativo
A curva de decaimento segue a equação abaixo.
R=R_{0}e^{-\lambda t}
- R_{0} é a taxa de decaimento quando t=0, ou seja, no momento da morte do organismo, em decaimentos/segundo ou becquerel (Bq).
- R é a taxa de decaimento atual.
- \lambda é a constante de desintegração, cujo valor é:
\lambda=\frac{ln2}{T_{1/2}}=\frac{ln2}{5730}=1,209\cdot 10^{-4}
- t é o tempo que se passou desde que o organismo morreu.
- T_{1/2} é a meia-vida do isótopo.
A fórmula para calcular t é apenas uma manipulação da equação anterior.
t=\frac{-ln(\frac{R}{R_{0}})}{-ln2}\cdot T_{1/2}
As equações mostradas servem para todos os isótopos e elementos radioativos.
Erros na medição
A datação por carbono 14 só é confiável para amostras de até 50.000 anos. A quantidade produzida na atmosfera não é constante, o que pode causar erros na medida.

Houve aumento na concentração deste isótopo devido aos testes nucleares no século passado. Gerando um pico na década de 1960.

Os seres vivos têm vários outros isótopos radioativos, como por exemplo, o potássio 40, cuja meia vida é de 1,248 bilhões de anos. Na próxima parte, explicarei os métodos usados para medir o decaimento de carbono 14.


